8月14日,国际高水平免疫学期刊Cellular & Molecular Immunology杂志在线发表了我校转化医学研究院题为“NAD+ salvage governs the immunosuppressive capacity of mesenchymal stem cells”的研究成果,该研究揭示了NAD+代谢是间充质干细胞(mesenchymal stem cells,MSCs)发挥免疫调控功能的基础。炎症“授权”的MSCs通过上调NAD+补救合成途径中关键限速酶烟酰胺磷酸核糖基转移酶(nicotinamide phosphoribosyltransferase,NAMPT)维持胞内NAD+稳态。NAD+代谢驱动琥珀酸盐-HIF1α轴以激活并维持糖酵解程序,从而赋予MSCs免疫抑制功能,使其发挥重要的疾病治疗效应。
借助于其突出的免疫调节特性和优良的组织修复能力,MSCs已成为多种难治性疾病的特殊细胞免疫制剂。自2004年MSCs首次成功治愈重症类固醇和环孢菌素耐药的移植物抗宿主病患者后,世界各国都在加紧基于MSCs的干细胞药物的探索和研发。当前在ClinicalTrials.gov上注册的关于MSCs与疾病治疗的临床试验研究已达1564项,其中中国占463项(占全球总项目数的30%)。与临床一线的免疫抑制性药物相比,MSCs的特殊治疗功效并不是系统性地降低免疫系统的功能,而是在于通过靶向高炎症状态下的免疫反应,降低机体的炎症损伤。虽然MSCs在多数临床试验中已证实具有较好的疾病治疗效果,但还是有部分临床研究并未取得预期疗效。这主要归咎于MSCs免疫调控功能的高度可塑性给基于此干细胞的疾病治疗带来了诸多的不确定性。如何实现MSCs的精准治疗,在优化其疾病疗效的同时,避免炎症加剧等不良反应的发生,将是未来干细胞治疗应用中亟待解决的问题。
为突破当前MSCs治疗瓶颈,加快我国干细胞临床转化与应用,我校转化医学研究院时玉舫和邵常顺教授团队的研究人员以干细胞免疫代谢为研究核心,以NAD+代谢为切入口,利用多组学技术发现炎症因子激活会导致MSCs内葡萄糖消耗的剧烈增加,同时伴随着NAD+利用的增多,进而诱使负责NAD+生成的救助合成途径中关键限速酶NAMPT表达的升高。与在其免疫细胞中的促炎效应相反,这一级联反应却是塑造MSCs免疫抑制功能表型的基础。应用抑制剂或慢病毒敲低致使NAMPT失能以耗竭胞内NAD+分子,可导致MSCs免疫调控功能的缺陷,进而减弱其对于炎症性肠病和急性肝损伤的治疗效应。机制上,NAMPT介导的NAD+代谢通过驱动线粒体内琥珀酸盐-HIF1α轴激活并维持胞质中的有氧糖酵解程序,进而塑造MSCs的免疫抑制功能,使其发挥重要的疾病治疗效应。提升胞内NAD+代谢、促进琥珀酸盐的积累和稳定HIF-1α蛋白都能够显著增强MSCs的免疫调控功能,进而优化其疾病治疗效能,为破局当前MSCs临床治疗困境提供诸多更加简易、安全和高效的技术方案。
我校转化医学研究院博士后房建凯为该论文的第一作者,时玉舫教授和邵常顺教授为该论文的共同通讯作者。该研究得到了科技部国家重点研发计划、国家自然科学基金委重点项目和青年项目的资助。
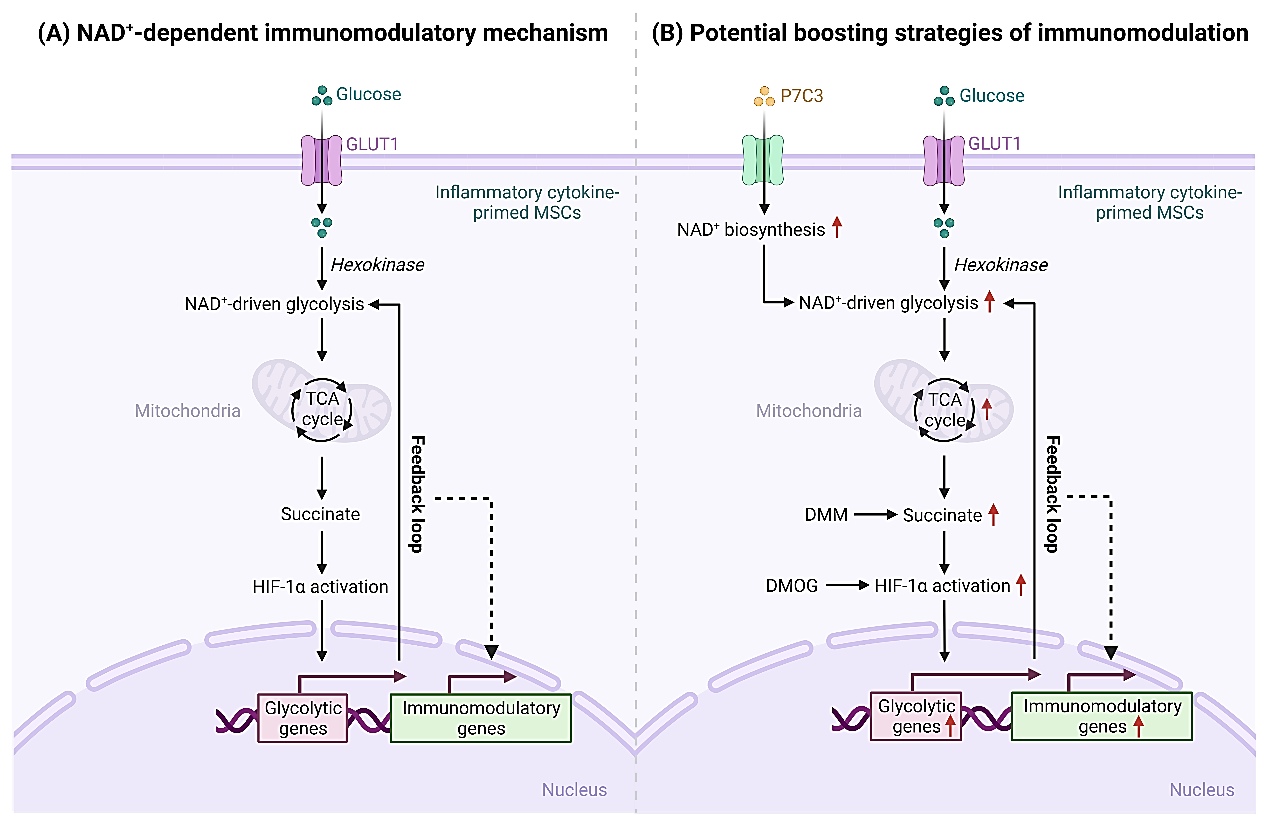
图注:NAD+代谢编程间充质干细胞免疫调控功能的作用机制与优化策略示意图






